המדע מגלה את סודות המיטוכונדריה, מערכת מופלאה שמאפשרת חיים, קוצבת אותם וגם מסבירה מחלות רבות
X זמן קריאה משוער: 18 דקות
במשך עשרות שנים, מאז שהתגלתה באמצע המאה ה-19 על ידי חוקר הרקמות, הפיזיולוג השוויצרי אלברט פון קוליקר, הציתה המיטוכונדריה את דמיונם של חוקרים בתחום הביולוגיה, שביצעו מחקרים פורצי דרך בתחום הביו-אנרגיה בשנות החמישים, השישים והשבעים. בשנים האחרונות, חוקרים רבים בתחום הפסיכולוגיה ומדעי המוח החלו מתעניינים גם הם בתפקידם של המבנים הללו בתוך התאים, בתהליכים המתרחשים במוח – ובעיקר בשינויים המתחוללים במוח עם הזדקנותו. מספר מחקרים בינתחומיים דווחו בכתבי העת של האגודה האמריקנית לחקר הפסיכולוגיה. למשל, בוני ג׳. קפלן (מאוניברסיטת שיקגו) ועמיתיה חקרו את הקשר בין תפקוד המיטוכונדריה לבריאות הנפש, במאמר שהתפרסם בשנת 2015 בכתב העת Clinical Psychological Science, ואילו בשנת 2019, במאמר שפורסם בכתב העת Current Directions in Psychological Science, חבר האגודה דייוויד גירי (מאוניברסיטת מיזורי) הציע קשר אפשרי בין תפקוד המיטוכונדריה לאינטליגנציה, בריאות והזדקנות.
לפניכם, אם כן, סקירה של מחקר עכשווי הבודק את האברון שממשיך לרתק חוקרים, בנקודות המפגש של הביולוגיה, המחקר הפסיכולוגי ומדעי המוח.
מתחנת הכוח של התא לסוכנת של מוות תאי
המיטוכונדריה היא חלק מהתא – אברון – המאופיין בקרום כפול. מספר המיטוכונדריות בתא משתנה בין יצורים, רקמות וסוגי תאים. הן קיימות בכל התאים האנושיים מלבד בתאי דם אדומים.
חוקרים העלו השערה שלפיה המיטוכונדריה הייתה במקור חיידק שיצר מערכת יחסים סימביוטית עם מיקרואורגניזמים – חי בתוכם, סיפק להם אנרגיה ובסופו של דבר אפשר להם להתפתח לאורגניזמים המורכבים מתאים מרובים בעלי גרעין, ובכלל זה גם בני אדם
אחת העובדות המדהימות בנוגע למיטוכונדריה היא שיש לה דנ"א משלה (אצל בני אדם, הוא כנראה מגיע רק מהאם, אם כי מחקרים אחרונים גילו עדויות אפשרויות לכך שניתן לרשת את הדנ"א המיטוכונדריאלי גם מהאב);למיטוכונדריה יש גם יכולת לשעתק דנ"א ולסנתז חלבון. מאפיינים אלה ומאפיינים ייחודים נוספים הופכים את המיטוכונדריה לדומה לחיידקים; למעשה, חוקרים העלו השערה שלפיה המיטוכונדריה הייתה במקור חיידק שיצר מערכת יחסים סימביוטית עם מיקרואורגניזמים – חי בתוכם, סיפק להם אנרגיה ובסופו של דבר אפשר להם להתפתח לאורגניזמים המורכבים מתאים מרובים בעלי גרעין, ובכלל זה גם בני אדם.
מאז שהמיטוכונדריה נראתה לראשונה במאה ה-19 ועד לשלהי שנות ה-70, מדענים גילו את מרבית הפרטים על האופן שבו היא מייצרת אנרגיה (אדנוזין תלת-זרחתי או ATP) ומפעילה את התאים. בשנות ה-80, על אף עשרות שנים של מחקר, המיטוכונדריה פסקה להיות נושא חם למחקר. אבל בשנת 1998, כתב העת Science פרסם גיליון מיוחד שעורר מחדש את התלהבותה של הקהילה המדעית. בזמנו, מספר מעבדות קבעו כי המיטוכונדריה והחלבונים המיטוכונדריאליים ממלאים תפקיד חשוב בקביעת מותו העתידי של התא. בעשורים שלאחר מכן, חוקרים גילו את פרטי תפקידה של המיטוכונדריה במותו והזדקנותו של התא, ואת האופן שבו חוסר תפקוד שלה קשור למחלות נדירות ונפוצות בבני אדם. מעבר לתפקידה בתהליכים ביואנרגנטיים, או האופן שבו אנרגיה מסופקת לתאים ונצרכת שם, למיטוכונדריה יש תפקיד מרכזי באחסון של יוני סידן, שלהם יש תפקיד חשוב בהעברת אותות בין תאים, בתיאום בין הורמונים ובשחרור מוליכים עצביים. בהתחשב בתפקידה החשוב במטבוליזם של התא, כשל בתפקוד המיטוכונדריה נקשר למחלות המשפיעות כמעט על כל איבר ומערכת בגופנו, ובשנת 1994, נטבע המונח ״רפואה מיטוכונדריאלית״. יתרה מזאת, בהתחשב ברגישות של הדנ"א המיטוכונדריאלי לתעוקה חימצונית, מוטציות ותביעות לשפע אנרגיה מצד המוח, לא מפתיע שכשל בתפקוד הדנ"א המיטוכונדריאלי נקשר למספר הפרעות נפשיות, שמשכו את תשומת לבם של חוקרי מוח וחוקרים בתחום הפסיכולוגיה. המחקר שנולד בעקבות זאת הראה כי ״יתכן שהמיטוכונדריות משמשות כתחנות הכוח של התא, אבל אין ספק שיש להן מגוון של פעילויות צדדיות״, כפי שכתבו בשנת 2013 דייוויד ג׳. פליאריני (מבית הספר לרפואה של אוניברסיטת וושינגטון בסנט לואיס) וג׳ראד ראטר (מאוניברסיטת יוטה).
מיטוכונדריה במוח
בשנת 2018, במאמר בכתב העת Perspectives on Psychological Science סקרו החוקרים פטר קרמר ופאולה ברסאן (מאוניברסיטת פדובה) את הראיות לקשר שבין כשל תפקודי של המיטוכונדריה להפרעות נפשיות. הם ציינו, למשל שהמיטוכונדריה מספקת אנרגיה לנוירונים כדי שיוכלו ״להידלק״ ומסייעת בוויסות התגובות הכימיות שדרושות לשם כך. בכל פעם שתא עצב משגר אות חשמלי, נכנסים אליו יונים של נתרן. אם נכנסת כמות מספיקה של נתרן, נפתחים ערוצים שמאפשרים גם כניסה של יוני סידן אל תאי העצב. כדי שתא העצב יוכל לשגר אות חשמלי נוסף, יונים של נתרן וסידן גם יחד צריכים לצאת מתוכו. אז המיטוכונדריה כולאת את הסידן זמנית בפנים, ומספקת אנרגיה למבנים אחרים בתא כדי שגם הם יכלאו יונים של סידן. אבל אם המיטוכונדריה צוברת יותר מדי סידן, היא הורסת את עצמה וגם את תא העצב המארח. זה קורה כאשר הפעילות החשמלית בנוירון עודפת, כמו במקרה של התקף אפילפסיה.

העתיד עוד לפנינו: אנחנו רק מתחילים להבין את תפקיד המיטוכונדריה בפעילות המוחית ובבריאות הנפש. תצלום: darkwood67
המיטוכונדריה מייצרת את החומרים ההופכים לסטרואידים ולנוירוסטרואידים, היכולים להשפיע על למידה, זיכרון ובריאות הנפש
כשתהליך כזה מתרחש באורח תקין, העלייה ברמת הסידן יכולה לגרום לנוירון להגיב טוב יותר לגירוי עתידי. בדומה לכך, רמות נמוכות מדי של סידן יכולות לגרום לתאי העצב להגיב פחות טוב. המיטוכונדריה משפיעה על שינוי התגובה הללו, הידועים כ״גמישות סינפטית״, על ידי חיזוק או ביטול של קשרי אנרגיה. ATP יכול גם לתפקד כמוליך עצבי – למשל, לאותת על כאב באמצעות הוראה לתאים ״לשפוך״ ATP אחרי פציעה ולהפעיל קולטנים מחוץ לתאים שהושפעו. בנוסף, המיטוכונדריה מייצרת את החומרים ההופכים לסטרואידים ולנוירוסטרואידים, היכולים להשפיע על למידה, זיכרון ובריאות הנפש. וכשישנה כמות עודפת של הורמונים ומוליכים עצביים אלה, או כשהם כבר אינם נדרשים, המיטוכונדריה היא שמפרקת אותם או מאפסנת אותם.
ההשלכות של כשל בתפקוד המיטוכונדריה
מה קורה כשהמיטוכונדריה נפגמת או אינה מתפקדת? קרמר וברסאן מצטטים מחקר של בוש (Boesch) ועמיתים, ומציינים כי לא רק שמיטוכונדריה פגומה ניתנת לתיקון, אלא שאם התיקון נכשל, חלקים ממנה שעדיין מתפקדים ניתנים למחזור. צמד מיטוכונדריות פגומות מתמזגות, משנות צורה ונפרדות שוב, כשהן יוצרות מיטוכונדריה אחת שכל חלקיה מתפקדים היטב, ומיטוכונדריה נוספת שחלקיה פגומים או הרוסים. אולם תאים שיש בהם יותר מדי מיטוכונדריות פגומות הופכים בעצמם לתאים שאינם מתפקדים; בשלב זה, הם מורים למיטוכונדריה שלהם להרוג אותם ואז להשמיד את עצמה. כשתהליך כזה מופרע, יכולה להיווצר מחלה.
מאחר שהמוח האנושי צורך לפחות 20 אחוז מהאנרגיה שמייצרת המיטוכונדריה וחילוף החומרים החימצוני של תא העצב מהיר פי עשרה מזה של תאים אחרים, כשל בתפקוד המיטוכונדריה עלול להשפיע עליו מאוד. תאי עצב משתמשים באנרגיה ללא הרף, בעיקר בסינפסות, ועל פי קרמר ובראסן, כשהמיטוכונדריה מפסיקה לתפקד, הם חייבים להיהרס ולהתחלף באחרים, או בקצות תאי העצב או אחרי שהם מסולקים משם. כשל בתהליכים אלה של הרס והעברה נקשר למחלות ניווניות של מערכת העצבים, כמו אלצהיימר ופרקינסון ואפילו לסכיזופרניה ולדיכאון.
מיטוכונדריה שאינה מתפקדת יכולה לייצר רמות גבוהות יותר של חומרים כימיים בעלי תגובתיות גבוהה (ROS, מולקולות המכילות חמצן ומיוצרות בתהליכי נשימה רגילים), דבר הגורם לתעוקה חמצונית ועלול לפגוע במבנה התא, הדי אן איי, האר אן איי והחלבונים. נזק שנגרם בשל ROS תורם למותו של התא, למחלות עצבים ניווניות ואפילו להזדקנות רגילה. ריכוזים גבוהים במיוחד של ROS נקשרו להפרעות קשב והיפראקטיביות, להפרעה דו-קוטבית, לסכיזופרניה פרנואידית ולהפרעות על הקשת האוטיסטית.
כשל בפעילות המיטוכונדריה על התפקוד העצבי עשויות לסייע להסביר מדוע חולי סכיזופרניה הם לעתים קרובות מדוכאים, מדוע רבים מהאוטיסטים סובלים מחרדה, למה בעלי תסמונת דאון נוטים לפתח דמנציה מוקדמת וכיצד דיכאון בהווה מנבא דמנציה בשלב מאוחר יותר
בנוסף לכך, מחקר משנת 2008 קושר בין תפקוד המיטוכונדריה לדיכאון עם תסמינים גופניים. גרדנר (Gardner) ובולס (Boles) הראו כי יצור מועט של ATP נקשר לתסמינים גופניים חמורים יותר אצל חולים הסובלים מדיכאון כרוני. בהתחשב בתוצאות אלה, ״חומרת התסמינים הגופניים עשויה להית סמן של ייצור מועט של ATP ואולי גם חומרת התסמינים הנפשיים״, כתבו קפלן ועמיתים בשנת 2015. קרמר וברסאן בדקו גם כיצד ההשלכות של כשל בפעילות המיטוכונדריה על התפקוד העצבי עשויות לסייע להסביר מדוע ״חולי סכיזופרניה הם לעתים קרובות מדוכאים, מדוע רבים מהאוטיסטים סובלים מחרדה, למה בעלי תסמונת דאון נוטים לפתח דמנציה מוקדמת וכיצד דיכאון בהווה מנבא דמנציה בשלב מאוחר יותר״.

כל תא בגוף חי כל כך הרבה יותר מסובך מכל מה שהאדם המציא ובנה. תצלום: oldTor
כשהמיטוכונדריה מזדקנת
ההבנה של האופן שבו תורמת המיטוכונדריה לתפקודי המוח האנושי עשויה גם להבהיר מהי השפעתה על הזדקנות של מוח בריא ועל מחלות עצביות הקשורות להזדקנות.
הביוכימאי דנהאם הרמן (Denham Harman) אפיין את ההזדקנות ההצטברות פרוגרסיבית של שינויים שבסופו של דבר אחראים ל״רגישות הולכת וגוברת למחלות ולבסוף למוות״. ״תאוריית הרדיקלים החופשיים של ההזדקנות״ שלו (משנת 1965) תיארה את ההזדקנות, וגם מחלות ניווניות הקשורות לזקנה, כתוצאה של רדיקלים חופשיים (אותם ROS שמיוצרים על ידי המיטוכונדריה) התוקפים תאים ורקמות. ובפרט, חוסר איזון בין ייצור של ROS והגנות נוגדות חמצון (פעולה נוספת של המיטוכונדריה) עלול לפגוע בתפקוד התאים. התופעה הזו נצפתה לא רק בהזדקנות רגילה אלא גם במקרים פתולוגיים רבים הקשורים בכשל בתפקוד המיטוכונדריה.
בנוסף, תאים מאבדים עם הגיל את היכולת למחזר אברונים ומקרו-מולקולות. הדבר מוביל לכשל בפעילות המיטוכונדריה, הבא לידי ביטוי בפגיעה ביכולת לספק אנרגיה לתאים ובעלייה בתעוקה החמצונית אשר, בתורה, מזיקה למיטוכונדריה. מוטציות בדנ"א המיטוכונדריאלי שלנו מתגברות גם הן ככל שאנחנו מזדקנים, ובסופו של דבר הן עלולות להוביל למות התא.
שינויים הקשורים בכשל בתפקוד המיטוכונדריה כנראה קשורים למחלת פרקינסון וגם להזדקנות
חוקרים אחרים קישרו בין הזדקנות למוטציות בדנ"א המיטוכונדריאלי בתאי העצב הקשורים לדופמין באזור מסוים במוח, אזור ״החומר השחור״. מוטציות דומות נמצאו אצל חולים הסובלים ממחלת פרקינסון, הפרעה עצבית ניוונית עם תסמינים כמו אובדן תנועה ורעד במנוחה. בפרימאטים, הזדקנות של תאי עצב (תהליך שבו הנוירונים מזדקנים ומפסיקים להתחלק אבל אינם מתים) נקשרה לשינויים בתפקוד המיטוכונדריה ולירידה בתנועה: אצל בעלי חיים זקנים יותר ישנה פחות פעילות מוטורית לעומת בעלי חיים צעירים, ופחות יצירה של ATP באזור החומר השחור ובפוטמן. ממצאים אלה רלוונטיים במיוחד משום שכמחצית מבני ה-85 ומעלה מראים סימנים קלים של מחלת פרקינסון. בסך הכול, שינויים הקשורים בכשל בתפקוד המיטוכונדריה כנראה קשורים למחלת פרקינסון וגם להזדקנות.

עוזר מחקר מסוג מקוק רזוס: עם ההזדקנות משתנה להם צורת המיטוכונדריה. תצלום: Cloudtail the Snow Leopard
יתרה מזאת, דנ"א מיטוכונדריאלי פגום באזור החומר השחור עלול לתרום לבעיות בתנועה שמתעוררות עם הגיל, לצד תוצאות הגיל. במחקר שנעשה על עכברים, החוקרים גילו עדויות לכך שלמכרסמים עם די אן איי מיטוכונדריאלי פגום היו פחות תאי עצב הקשורים בדופמין, וסימנים של הזדקנות שכללו בריחת סידן מן העצמות, עקשת (שהיא סוג של גיבנת) ואובדן משקל.
מיטוכונדריות משנות את צורתן בתהליך מוסדר של התארכות והתקצרות, ונעות באורח אקטיבי בין חלקי תאי העצב. שינויי הצורה והתפקוד הללו מושפעים מאותות המגיעים מחוץ לתא ומן הסביבה המטבולית והם עשויים להשפיע על תהליך ההזדקנות של התא
מן המחקרים עולה גם שמיטוכונדריות משנות את צורתן בתהליך מוסדר של התארכות והתקצרות, ונעות באורח אקטיבי בין חלקי תאי העצב. שינויי הצורה והתפקוד הללו מושפעים מאותות המגיעים מחוץ לתא ומן הסביבה המטבולית והם עשויים להשפיע על תהליך ההזדקנות של התא.
במאמר שפורסם בשנת 2014 בכתב העת Proceedings of the National Academy of Sciences, החוקרת יוקו הארה (מבית הספר לרפואה במרכז מאונט סיניי בניו יורק) ועמיתים, חשפו את הקשר בין הזדקנות, המורפולוגיה של המיטוכונדריה והקוגניציה אצל קופי מקוק-רזוס. הם גילו שבאזור במוח המקושר לזיכרון עבודה, המיטוכונדריה של קופים צעירים היא בעלת צורה רגילה, ואילו אצל קופים מבוגרים יותר המיטוכונדריה היא בעלת צורה חריגה כתוצאה מתעוקה חמצונית. נוכחותן של מיטוכונדריות כאלה, בעלות צורה חריגה, נקשרה לירידה בזיכרון העבודה. אולם, אסטרדיול, הורמון שיש לו השפעה נוגדת חמצון, התגלה כמשנה גם את נוכחות המיטוכונדריות הללו וגם את הפגמים בזיכרון העבודה. מכאן שממצאיהם של הארה ועמיתיה עולה כי ״טיפול בהורמונים חלופיים משפר את הקוגניציה בעת ההזדקנות, בחלקו על ידי שיפור בריאות המיטוכונדריה והסינפסות בקליפת המוח הקדם-מצחית״.
מחלות עצבים ניווניות וכשל בתפקוד המיטוכונדריה
הגיל הוא גורם הסיכון העיקרי להפרעות עצביות ניווניות, ובכלל זה מחלת אלצהיימר שמתחילה בתסמינים קוגניטיביים כקושי להיזכר באירועים קרובים, וככל שהמחלה מתקדמת אובדים תפקודים גופניים, עד למוות. שכיחות המחלה בקרב אמריקנים בני 65 ומעלה צפויה לגדול מ-6 מיליונים כיום ל-12.7 מיליונים בשנת 2050, אלא אם תהיה פריצת דרך רפואית שתמנע, תאט או תרפא את המחלה (נתונים על כך כאן). שלא במפתיע, למיטוכונדריות יש יד גם במחלת אלצהיימר.
אחד מהתסמינים המוקדמים של מחלת אלצהיימר, המופיע עוד לפני שמופיעים הסימנים הפתולוגיים ברקמות ותסמינים אחרים, הוא ירידה בספיגת הגלוקוז, התואמת את השינויים בתהליכים הביו-אנרגטיים במוח. מחקרים הראו כי אצל חולי אלצהיימר, קצב המטבוליזם של הגלוקוז באזורי מוח הקשורים בתהליכי זיכרון, כמו ההיפוקמפוס והאונות הקדקודיות, יורד ב-20-30 אחוז. אף שהמחקר נמשך, ישנם חוקרים שהעלו את ״השערת השרשרת המיטוכונדריאלית״ כדי להסביר את התפרצות המחלה. על פי ההשערה הזו, גורמים גנטיים משפיעים על מגוון של תפקודים מיטוכונדריאליים אשר בתורם הופכים את המוח לפגיע לאלצהיימר. כתוצאה מכך, כשל בתפקוד המיטוכונדריה הוא המעורר הראשי של שרשרת אירועים המובילה למחלה. ההשערה עדיין נבדקת, אבל המורפולוגיה של המיטוכונדריה, תהליכים ביו-אנרגטיים, הביוגנסיס של המיטוכונדריה (כלומר יצירתה של מיטוכונדריה חדשה) וכן העברתה והריסתה כולם כנראה לקויים אצל חולים במחלת אלצהיימר.
שמירה על בריאות המיטוכונדריה
ישנן שתי התערבויות שכנראה משפרות את התוצאות הקשורות בהזדקנות של המיטוכונדריה: גישות פרמקולוגיות ממוקדות, כמו נוגדי חמצון ושינויים באורח החיים
אף שהמחקרים על מיטוכונדריות והקשר שלהם להזדקנות עדיין מתפתחים ואינם מציעים המלצות חד משמעיות, ישנן שתי התערבויות שכנראה משפרות את התוצאות הקשורות בהזדקנות של המיטוכונדריה: גישות פרמקולוגיות ממוקדות, כמו נוגדי חמצון (למשל, גינקו בילבואה) ושינויים באורח החיים.
באשר לשינויים באורח החיים, מרטין פיקארד (מאוניברסיטת פנסילבניה) ועמית האגודה ברוס ס. מקיואן (מאוניברסיטת רוקפלר) הציעו בשנת 2014 בדברי פרשנות שהתפרסמו בכתב העת Proceedings of the National Academy of Sciences, כי תרגילי התעמלות וצורות אחרות של פעילות גופנית עשויים לתרום למוח באמצעות תמיכה בדינמיקה בריאה של המיטוכונדריה ובכלל זה הביוגנסיס. ״מגוון הגישות שלנו לקידום האדפטיביות של המוח ולשימור תפקודו עם ההזדקנות אמור להרוויח מנקודת המבט הביו-אנרגטית באופן שבו המוח מתפקד ומגיב באורח דינמי לסביבתו״, כתבו פיקארד ומקיואן.
בדומה להם, גם קרמר וברסאן הדגישות את חשיבות אורח החיים להאטת התדרדרות הקשורה הגיל. שינה עשויה לסייע לניקוי רעלים מן המוח על ידי סילוק החלבון בטא-עמילואיד, חומר הפוגע בתאי עצב ובמיטוכונדריה כשהוא מצטבר בכמויות גדולות. מחסור בשינה עלול להזיק למיטוכונדריה, להפריע בלמידה וזיכרון ובסופו של דבר להוביל לדמנציה ולמוות.
אכילה מדודה גם היא מקדמת תיקון של המיטוכונדריות ויצירה של ATP ומגינה על תאים, ובכלל זה תאי עצב. ההשפעות האלה מתרחשות כנראה באמצעות אותו מנגנון של דלדול בגלוקוז, שפועל כשעוסקים בפעילות גופנית
אימון גופני כנראה שומר על בריאות הדנ"א המיטוכונדריאלי, עם פחות מוטציות, בין שאר היתרונות. במהלך תרגילי התעמלות ממושכים, הגוף והמוח ממשיכים להוציא אנרגיה בעוד שמקור האנרגיה הרגיל, גלוקוז, מידלדל. המיטוכונדריה משתמשת אז בסוג אחר של ״דלק״, ויוצרת שרשרת של תגובות שבסופו של דבר מעוררת ייצור של גורם נוירופטי מוחי (BDNF), חלבון שמעודד צמיחה ותיקון של תאי עצב וסינפסות.
אכילה מדודה גם היא מקדמת תיקון של המיטוכונדריות ויצירה של ATP ומגינה על תאים, ובכלל זה תאי עצב. ההשפעות האלה מתרחשות כנראה באמצעות אותו מנגנון של דלדול בגלוקוז, שפועל כשעוסקים בפעילות גופנית.

נראה כי דיאטה ים תיכונית טובה למיטוכונדריה ומונעת סדרה ארוכה של מחלות, יחד עם פעילות גופנית סדירה. תצלום: נדין פרימו
תזונה מאוזנת יכולה גם היא לצמצם את התעוקה החמצונית של המיטוכונדריה ולתרום לבריאותה ולבריאות התאים. למשל, הדיאטה הים תיכונית – במאופיינת ברמות גבוהות של שמן זית, דגנים לא מעובדים, פירות, ירקות ודגים – קשורה כנראה לפחות מקרים של מחלת אלצהיימר.
הפחתת לחצים (למשל באמצעות מדיטציה או טכניקות הירגעות) עשויה להפחית נזקים של רדיקלים חופשיים ולהגן על המיטוכונדריה, וגם לתמוך ביצירת ATP ושימושו בתאים. לחצים כרוניים ברמה גבוהה עלולים לסכל את פעילות ה-BDNF, להגביר את ייצור הרדיקלים החופשיים ולהפחית את יכולתה של המיטוכונדריה ליצור ATP ולכלוא את הסידן הנדרש ליצירת אנרגיה בתאים.
הבנה טובה יותר של המיטוכונדריה בהקשר של הזדקנות, ובעיקר הזדקנות המוח, עשויה לסייע לזהות שיטות טיפול שיוכלו לשפר מצבי זקנה ואפילו למנוע ניוון עצבי
מעבר לגישות אלה, הבנה טובה יותר של המיטוכונדריה בהקשר של הזדקנות, ובעיקר הזדקנות המוח, עשויה לסייע לזהות שיטות טיפול שיוכלו לשפר מצבי זקנה ואפילו למנוע ניוון עצבי. הבנה כזו תתאפשר כנראה רק אם צוותים בינתחומיים שיכללו בין השאר ביולוגים, חוקרי מוח וחוקרים מתחום הפיזיולוגיה, יעבדו ביחד כדי ללמוד יותר על התפקיד המרכזי שיש כנראה למיטוכונדריה בכל התפקוד האנושי. הכרה במרכזיות של תפקוד המיטוכונדריה במחלות גופניות, פסיכיאטריות ועצביות רבות, כמו גם בהזדקנות רגילה, ״עשויה להועיל בזיהוי השפעות גנטיות וסביבתיות על התפתחות האינטליגנציה ועל קצב הירידה בקוגניציה בשל הגיל״, כתב גירי במאמר משנת 2109 שהתפרסם בכתב העת Current Directions in Psychological Science. בנוסף, הוא המשיך, ״שיטות הטיפול החדשות במחלות ספציפיות (למשל אלצהיימר) באמצעות המיטוכונדריה עשויות להתגלות כיעילות במיוחד, בעיקר עבור שיפור פגיעה סביבתית או פגיעה כתוצאה מגיל בבריאות ובקוגניציה״.
מקורות:Alzheimer’s Association. (2021). 2021 Alzheimer’s disease facts and figures. Alzheimer’s & Dementia, 17(3), 327–406. https://doi.org/10.1002/alz.12328
Bélanger, M., Allaman, I., & Magistretti, P. J. (2011). Brain energy metabolism: focus on astrocyte-neuron metabolic cooperation. Cell Metabolism, 14(6), 724–738.
Biskup, S., & Moore, D. J. (2006). Detrimental deletions: Mitochondria, aging and Parkinson’s disease. Bioessays, 28(10), 963–967. https://doi.org/10.1002/bies.20471
Boesch, P., Weber-Lotfi, F., Ibrahim, N., Tarasenko, V., Cosset, A., Paulus, F., Lightowlers, R. N., & Dietrich, A. (2011). DNA repair in organelles: Pathways, organization, regulation, relevance in disease and aging. Biochimica et Biophysica Acta—Molecular Cell Research, 1813(1), 186–200. https://doi.org/10.1016/j.bbamcr.2010.10.002
Cao, X., Zhao, Z. W., Zhou, H. Y., Chen, G. Q., & Yang, H. J. (2012). Effects of exercise intensity on copy number and mutations of mitochondrial DNA in gastrocnemus muscles in mice. Molecular Medicine Reports, 6, 426–428. https://doi.org/10.3892/mmr.2012.913
Cenini, G., & Voos, W. (2019). Mitochondria as potential targets in Alzheimer disease therapy: An update. Frontiers in Pharmacology, 10, Article 902. https://doi.org/10.3389/fphar.2019.00902
Chan, D. C. (2012). Fusion and fission: Interlinked processes critical for mitochondrial health. Annual Review of Genetics, 46, 265–287. https://doi.org/10.1146/annurev-genet-110410-132529
Deheshi, S., Pasqualotto, B. A., & Rintoul, G. L. (2013). Mitochondrial trafficking in neuropsychiatric diseases. Neurobiology of Disease, 51, 66–71. https://doi.org/10.1016/j.nbd.2012.06.015
Ernster, L., & Schatz, G. (1981). Mitochondria: A historical review. Journal of Cell Biology, 91(3), 227s–255s.
Frye, R. E., & Rossignol, D. A. (2011). Mitochondrial dysfunction can connect the diverse medical symptoms associated with autism spectrum disorders. Pediatric Research, 69(8), 41–47. https://doi.org/10.1111/j.1469-8749.2011.03980.x
Gardner, A., & Boles, R. G. (2011). Beyond the serotonin hypothesis: Mitochondria, inflammation and neurodegeneration in major depression and affective spectrum disorders. Progress in Neuro-Psychopharmacology and Biological Psychiatry, 35(3), 730–743. https://doi.org/10.1016/j.pnpbp.2010.07.030
Geary, D. C. (2019). The spark of life and the unification of intelligence, health, and aging. Current Directions in Psychological Science, 28(3), 223–228. https://doi.org/10.1177/0963721412469398
Green, D. R., & Reed, J. C. (1998). Mitochondria and apoptosis. Science, 1309–1312. https://doi.org/ 10.1126/science.281.5381.1309
Grimm, A., & Eckert, A. (2017). Brain aging and neurodegeneration: From a mitochondrial point of view. Journal of Neurochemistry, 143(4), 418–431. https://doi.org/10.1111/jnc.14037
Harman, D. (1981). The aging process. Proceedings of the National Academy of Sciences, 78(11), 7124–7128.
Huang, Y., Potter, R., Sigurdson, W., Santacruz, A., Shih, S., Ju, Y.-E., Kasten, T., Morris, J. C., Mintun, M., Duntley, S., Bateman, R. J. (2012). Effects of age and amyloid deposition on Aß dynamics in the human central nervous system. Archives of Neurology, 69, 51–58. https://doi.org/10.1001/archneurol.2011.235
Kaplan, B. J., Rucklidge, J. J., Romijn, A., & McLeod, K. (2015). The emerging field of nutritional mental health: Inflammation, the microbiome, oxidative stress, and mitochondrial function. Clinical Psychological Science, 3(6), 964–980. https://doi.org/10.1177/2167702614555413
Karstens, A. J., Tussing-Humphreys, L., Zhan, L., Rajendran, N., Cohen, J., Dion, C., Xiahong, J. Z., & Lamar, M. (2019). Associations of the Mediterranean diet with cognitive and neuroimaging phenotypes of dementia in healthy older adults. American Journal of Clinical Nutrition, 109(2), 361–368. https://doi.org/10.1093/ajcn/nqy275
Kramer, P., & Bressan, P. (2018). Our (mother’s) mitochondria and our mind. Perspectives on Psychological Science, 13(1), 88–100. https://doi.org/10.1177/1745691617718356
Kraytsberg, Y., Kudryavtseva, E., McKee, A. C., Geula, C., Kowall, N. W., & Khrapko, K. (2006). Mitochondrial DNA deletions are abundant and cause functional impairment in aged human substantia nigra neurons. Nature Genetics, 38(5), 518–520.
Niccoli, T., & Partridge, L. (2012). Ageing as a risk factor for disease. Current Biology, 22(17), R741–R752. https://doi.org/10.1016/j.cub.2012.07.024
Pagliarini, D. J., & Rutter, J. (2013). Hallmarks of a new era in mitochondrial biochemistry. Genes & Development, 27(24), 2615–2627. https://doi.org/10.1101/gad.229724.113
Pandya, J. D., Grondin, R., Yonutas, H. M., Haghnazar, H., Gash, D. M., Zhang, Z., & Sullivan, P. G. (2015). Decreased mitochondrial bioenergetics and calcium buffering capacity in the basal ganglia correlates with motor deficits in a nonhuman primate model of aging. Neurobiology of Aging, 36(5), 1903–1913. https://doi.org/10.1016/j.neurobiolaging.2015.01.018
Picard, M., & McEwen, B. S. (2014). Mitochondria impact brain function and cognition. Proceedings of the National Academy of Sciences, 111(1), 7-8. https://doi.org/10.1073/pnas.1321881111
Rango, M., & Bresolin, N. (2018). Brain mitochondria, aging, and Parkinson’s disease. Genes, 9(5), 250. https://doi.org/10.3390/genes9050250
Swerdlow, R. H., & Khan, S. M. (2004). A “mitochondrial cascade hypothesis” for sporadic Alzheimer’s disease. Medical Hypotheses, 63(1), 8–20. https://doi.org/10.1016/j.mehy.2003.12.045
Youle, R. J., & van der Bliek, A. M. (2012). Mitochondrial fission, fusion, and stress. Science, 337(6098), 1062–1065. https://doi.org/10.1126/science.1219855
לודמילה נונס (Ludmila Nunes) היא כתבת של בטאון האגודה האמריקנית לחקר הפסיכולוגיה.
המאמר פורסם במקור ב-Association for Psychological Science. כל הזכויות שמורות לאלכסון.
תרגמה במיוחד לאלכסון: דפנה לוי
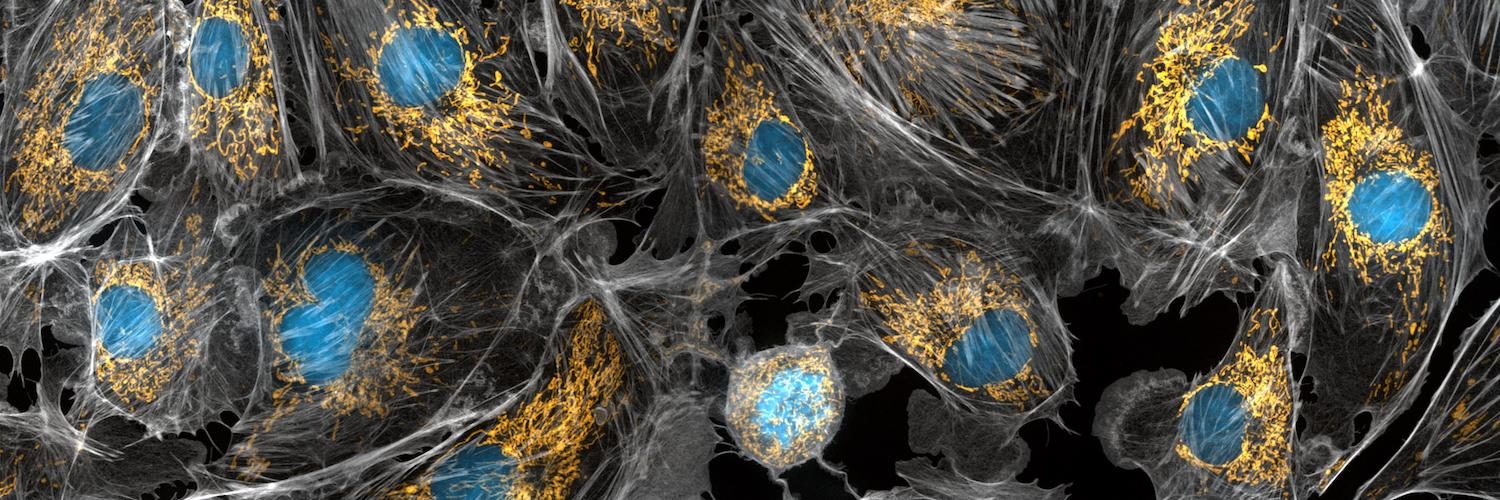
תמונה ראשית: מיטוכונדריה (בזהוב), גרעיני תא (בכחול), בתוך מבנה התא. תצלום: אוסף ה-NIH, ביצוע של Torsten Wittmann מאוניברסיטת קליפורניה (סן פרנסיסקו).
 מחשבות מתחילות כאן
מחשבות מתחילות כאן
תגובות פייסבוק
תגובה אחת על המנוע המסתורי של החיים
ראונדאפ (גלייפוסט) הוא עדיין קוטל העשבים הנפוץ בעולם. נכנס לשימוש מסחרי בשנות השישים ותואר כקוטל עשבים כללי, סיסטמי, ללא שום סיכון לחקלאים ולצרכנים. חברות מסחריות פיתחו זנים עמידים (גן RR) שפתרו לחקלאים את התחרות עם עשבי בר בפשטות ובקלות על ידיד ריסוסים חוזרים. הכל השתנה כשהפטנט על ייצור החומר נגמר, וסוללת עורכי הדין שהגנה עליו פרשה. הופיעו מחקרים שהציפו בעיות לרססים ולצרכנים. את כל זה אני מספר, כי למיטב ידיעתי המנגנון העיקרי והחמקמק שמוצע להסבר על נזקי הגלייפוסט הוא על ידי פגיעה במיטכונדריה. גם חשיפה לכמויות ממש זעירות של החומר, מספיקות להשראת שינויים גורמי נזק. הבעייה היא שלוקח לנזק הזה הרבה שנים להתבטא.
אמני תשומת הלב
מארק גרייףגיבורי התרבות האמריקניים בימי המלחמה הקרה לא הצליחו בזכות חזון ומטרה, אלא...
X רבע שעה
סופרים קוראים
פרקי הפודקאסט הזה הם אוצר בלום עבור חובבי ספרות, ובעיקר עבור שוחרי הסיפור הקצר. The Writer’s Voice: Fiction from the Magazine מציג בכל פרק סיפור קצר אחר, בקולם של הסופרת או הסופר. הקונספט פשוט - התוצאה מסחררת, מרגשת, מצחיקה, טורדת מנוחה ומרחיבת נפש במיוחד.
רשימה חלקית של הסופרים והסופרות הקוראים מיצירותיהם בפודקאסט: אסתר פרויד, האן אונג, ג׳ורג׳ סונדרס, הורמאט קאזמי, בריאן וושינגטון, מרגרט אטווד, סטרלינג הוליוויטמאונט, אימבולו מבואה, ג׳ונתן לת׳ם, ג׳ומפה להירי, סלמן רושדי, רודי דויל, טה פינג צ׳ן ופט בארקר. עשרות הפרקים הם ארכיון נדיר של קולות ונקודות מבט מפיעות על העולם.
טעות בזיהוי
ראשית התעלומה בגופה שנמצאה במקום בעל השם המסקרן Goat’s Hole Cave, בחצי האי גוואר אשר בווילס. החוקרים הראשונים שהגיעו למקום נדהמו לגלות בו שלל ממצאים משונים ואז גם התברר שמדובר בשרידי אדם בני יותר מ-34 אלף שנה. בהיעדר עדים, הארכיאולוגים נאלצו לעשות כמיטב יכולתם ולטוות סיפור רקע: מדובר באישה, כנראה זונה, שנקברה במקום רחוק מן הקהילה שלה, וגופתה עוטרה במיני סימנים פולחניים. אבל משהו בכל זאת לא הסתדר... וחקירה נוספת גילתה סיפור אחר, מסעיר ונוגע ללב.